Stap 1: Coëfficiënten versus subscript


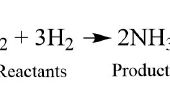
Bij het naderen van een chemische vergelijking, is het belangrijk dat jullie het verschil tussen de coëfficiënten en subscript begrijpen. De coëfficiënt wordt geplaatst voor een molecuul, terwijl het subscript bepaalde atomen, volgt zoals in de eerste afbeelding.
In een molecuul geeft de coëfficiënt het bedrag van dat molecuul aanwezig. De subscript van een atoom geeft aan het bedrag van dat atoom in het molecuul. Bijvoorbeeld, in de eerste afbeelding geeft de coëfficiënt voor de tweede termijn 3 moleculen van H2 aanwezig zijn, waardoor de subscript van de eerste term betekent dat 2 atomen stikstof (N) aanwezig per molecuul van N2 zijn. Als er niet een subscript aanwezig op een element, kunt u afleiden is er slechts één atoom van dat element.
Het toevoegen van een coëfficiënt voor een molecuul vermenigvuldigt alle atomen binnen dat molecuul door het nummer van de coëfficiënt. Als een atoom een subscript heeft, vermenigvuldigen de coëfficiënt en de subscript om de opbrengst van het totale bedrag van dat atoom in het molecuul. Bijvoorbeeld, in de tweede foto is de coëfficiënt voor ammoniak (NH3) aan de kant van de producten 2. De 2 wordt vermenigvuldigd met de subscript van waterstofgas, dat 3 is, levert een totaal aantal waterstofatomen gelijk aan 6.
De coëfficiënt is het deel dat kan worden gewijzigd en toegevoegd wanneer een vergelijking te balanceren. De coëfficiënt wijzigt, wordt het totale aantal dat molecuul. Het subscript, echter, kan niet worden gewijzigd. Wijzigen van een subscript zou het molecuul zelf veranderen.